Méthodes de mesure
Note : nous conseillons la lecture de l’ouvrage de Slavík (1974), consacré aux méthodes d’étude des relations hydriques dans les plantes.
3.1. Potentiel hydrique : la méthode psychrométrique
Cette méthode consiste à mesurer le potentiel hydrique de l'air en équilibre avec un échantillon végétal ou de sol contenant de l’eau. Il s’agit essentiellement d’une méthode de laboratoire, largement utilisée par les chercheurs, qui s’est développée à partir des années 1970 (Brown, 1970). L’appareil, appelé micropsychromètre (voir Fig. 2), consiste en une petite chambre de mesure dont il existe deux principales variantes. Dans la première, on insère dans la chambre un petit échantillon végétal (un disque de feuille par exemple), puis on referme l’appareil de façon hermétique. On laisse s’équilibrer pendant quelques minutes le potentiel hydrique de l’échantillon avec l’air qui le surmonte. Une fois cet équilibre atteint, on mesure l’humidité relative de l’air par la méthode psychrométrique (voir ci-dessous). La seconde variante de cet appareil (Dixon et Tyree, 1984, qui ont repris certaines idées de Brown, 1970) permet de mesurer le potentiel hydrique d'une tige ou d'une branche.
Une version plus élaborée de ces équipements utilise un double thermocouple permettant de faire une correction de température lorsqu’il existe un gradient de température entre l’échantillon et l'air de la chambre psychrométrique (Fig. 2).
La mesure elle-même consiste, une fois l’échantillon en équilibre de potentiel hydrique dans la chambre micropsychrométrique, à mesurer l’humidité relative de l’air de la chambre. Celle-ci se déduit de la mesure successive de deux températures : 1) celle de l’air dans la chambre (Ta), puis 2) la température du point de rosée (Tr), qui est celle, à pression constante, où il y a équilibre entre condensation et évaporation de l’eau. Ainsi, le boîtier de mesure contient un microvoltmètre, qui est utilisé pour mesurer la tension aux bornes des différents thermocouples et de la convertir en température, la relation étant linéaire et connue (40 μV/°C pour le couple cuivre-constantan). Le boîtier contient aussi un générateur de courant continu régulé qui, après avoir mesuré la température de l’air (Ta sur la Fig. 2), fait passer dans ce thermocouple un courant de faible intensité, qui le refroidit progressivement par effet Peltier. Un système électronique est capable de détecter la température du point de rosée et de s’y maintenir.
Le potentiel hydrique de la vapeur d’eau dans l’air (Ya, en Pa) est donné par la formule de Kelvin :
Ya = RTa/Vw ln(e/e0) (7)
avec :
R : constante des gaz parfaits (8.314 J mol-1 K-1) ;
Ta : température absolue (K) ;
Vw : volume molaire de l’eau (1.8 10-5 m3 mol-1) ;
e/e0 : humidité relative de l’air, avec e : la pression partielle de vapeur d’eau dans l’air (en Pa), qui se calcule à partir de la température Ta et de l’écart Ta-Tr. e0 est la pression partielle de vapeur saturante à la température Ta qui se calcule avec une formule physique simple.
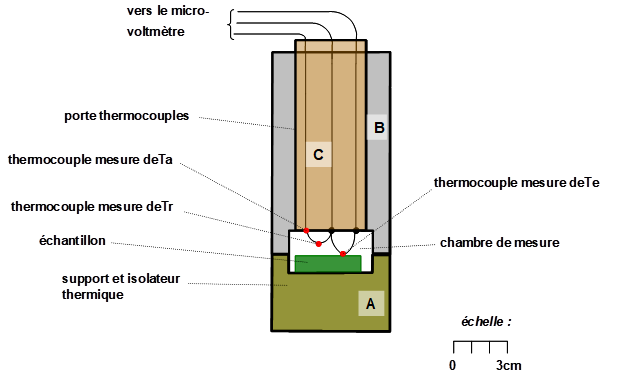
Figure 2. Schéma d’un micropsychromètre pour la mesure du potentiel hydrique d’un échantillon végétal ou de sol. Le système se compose d’une petite chambre ménagée à la jonction de deux pièces (A et B) qui peuvent s’assembler au moyen d’un pas de vis (non représenté ici). Dans la partie supérieure vient s’insérer une pièce cylindrique (C) portant trois thermocouples, ici figurés par de petits cercles rouges. L’un d’eux est utilisé pour mesurer la température de l’échantillon (Te), le second, mesure soit la température du point de rosée (Tr) soit la température humide (Th), le troisième mesure la température du support. Cette dernière mesure permet d’apporter une éventuelle correction si un gradient de température significatif est constaté entre le support et l’échantillon.
3.2. Potentiel hydrique : la chambre à pression
La chambre à pression (appelée aussi chambre de Scholander) a été inventée par H. Dixon, l'auteur avec Joly, de la fameuse et toujours actuelle théorie de la tension-cohésion. Malheureusement, le prototype inventé par Dixon était fabriqué en verre ; il a éclaté lorsque la pression a dépassé 3 bar (0.3 MPa). Oubliée, la chambre à pression a été redécouverte par Scholander et fabriquée en métal, plus d’un demi-siècle plus tard (Scholander et al., 1964), sans que ces auteurs aient fait référence aux travaux de Dixon.
Nous détaillons ici cette méthode, qui est fondée sur un principe fondamentalement différent de celui du micropsychromètre. Voir son schéma représenté sur la Fig. 3 avec son alimentation en gaz comprimé, généralement de l’azote, provenant d’une bouteille munie d’un manomètre-détendeur. À la transpiration d’une feuille attachée à une branche est associée une valeur moyenne de potentiel foliaire Yf dont la chambre de pression vise à déterminer la valeur. La technique, très simple de mise en œuvre, consiste à enfermer une feuille (ou un petit rameau) dans un sac en plastique destiné à maintenir une atmosphère saturée en vapeur d’eau. On coupe alors le pétiole avec une lame de rasoir, on place cette feuille dans la chambre de pression, on serre le joint en caoutchouc assurant l’étanchéité, puis on ferme le couvercle[2]. La feuille ayant été sectionnée, la tension présente lorsqu’elle était attachée à la plante s’est relâchée et la sève est absorbée par les tissus foliaires. On augmente ensuite lentement la pression du gaz à l'intérieur de la chambre jusqu'à l'apparition, sur la section extérieure du pétiole, d'un ménisque plat de sève[3]. La pression dans la chambre est alors notée. A ce stade, on admet que la pression gazeuse exerce une contrainte mécanique identique à celle qui existait dans la feuille en place du fait de la tension de l’eau, de sorte que se trouve reconstituée la répartition initiale de l’eau dans les tissus et les vaisseaux. La valeur de P pour laquelle on obtient la remontée de sève brute jusqu’à la coupure s'appelle la pression d'équilibre P, qui est égale à -Yf (pour être rigoureux, il faudrait ajouter le potentiel osmotique mais celui-ci est le plus souvent négligeable par rapport à P). En effet, au moment où le ménisque est créé, la somme P + Yf est égale à 0.
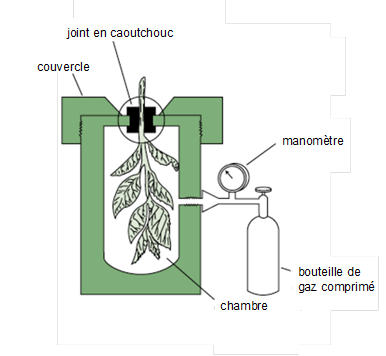
Figure 3. Coupe schématique d’une chambre à pression renfermant un petit rameau feuillé. On remarque l’épaisseur importante de ses parois métalliques, afin de résister à des pressions élevées. L’observateur regardel’extrémité de ce rameau avec une loupe à grossissement suffisant. Tiré de l’ouvrage de Taiz et al. (2015).
Le mécanisme est le suivant : aussitôt que le pétiole de la feuille transpirante est coupé, la sève brute, auparavant sous tension dans les éléments du xylème et portée subitement à la pression atmosphérique, recule très rapidement vers l'intérieur de la feuille, vers les cellules du limbe. On démontre aisément que la sève brute ne peut pas être retenue par capillarité dans les éléments conducteurs, même pour les diamètres les plus faibles (de l’ordre de 20 µm) observés chez certaines plantes. Le potentiel capillaire hydrique maximal est au maximum de moins quelques dixièmes de bars (avec un signe négatif, c’est une tension et non une pression). On peut calculer sa valeur (h, en Pa) au moyen de la loi de Laplace, en supposant un vaisseau conducteur de forme cylindrique :
h = 2 g /r (8)
avec :
g = tension superficielle de la sève (» celle de l'eau pure) = 0,073 N/m
r = rayon du vaisseau, en m.
Comme les diamètres des vaisseaux et des trachéïdes sont le plus souvent compris entre 20 et 300 µm, le potentiel maximal Yx dans ces éléments, après la coupure, va y être au plus de quelques dixièmes de bars. Ainsi après la coupure et même en prenant en compte le potentiel osmotique de la sève (en général moins d'un bar) le Yx devient brusquement très supérieur (moins négatif) que celui des cellules foliaires, Yf. En d'autres termes le fait de couper le pétiole crée une différence de potentiel hydrique entre les vaisseaux (qui forment, avec les parois cellulaires, l'apoplasme) et les cellules foliaires (dont l'ensemble forme le symplasme). La sève passe donc des vaisseaux dans les cellules adjacentes et c'est la raison pour laquelle elle se retire dans la feuille. Quand, une fois la feuille enfermée dans la chambre, on augmente lentement la pression, les cellules du mésophylle sont pressées et un mouvement inverse de la sève s'amorce, depuis les cellules vers les vaisseaux. Il est important de souligner les hypothèses qui sous-tendent ce raisonnement :
- les vaisseaux bien qu’extrêmement rigides sont considérés comme parfaitement élastiques (ils retrouvent donc, à la pression P, le volume qu'ils avaient sur la feuille en place) par rapport aux cellules du mésophylle ;
- la concentration de la sève du xylème, très faible ne change pas au cours de la mesure ;
- l'organe n'a pas perdu d'eau.
Il faut remarquer que le potentiel hydrique mesuré grâce à une chambre à pression représente le potentiel moyen d'un organe végétal intact, non transpirant, et dont l'apoplasme est supposé rempli d'une solution à faible concentration, la sève brute.
Chambre à pression et micropsychromètre
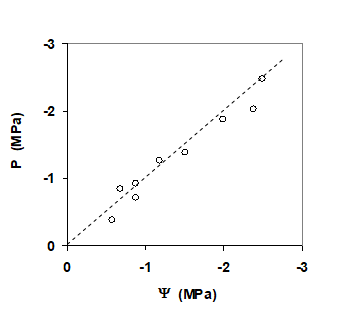 L’accord entre les deux méthodes, chambre à pression et micropsychromètre, est souvent très satisfaisant lorsque l’on manipule avec soin. C’est ce qui est montré sur la Fig. 4, les mesures ayant été réalisées sur les échantillons végétaux. Voir aussi les travaux de Dixon et Tyree (1984).
L’accord entre les deux méthodes, chambre à pression et micropsychromètre, est souvent très satisfaisant lorsque l’on manipule avec soin. C’est ce qui est montré sur la Fig. 4, les mesures ayant été réalisées sur les échantillons végétaux. Voir aussi les travaux de Dixon et Tyree (1984).

Figure 4. Comparaison de mesures de potentiel hydrique réalisées avec une chambre à pression (P) et un micropsychromètre à thermocouples (Y) sur des feuilles de soja. Le segment de droite en noir pointillé représente la première bissectrice. Repris de Boyer et Ghorashy (1971).
|
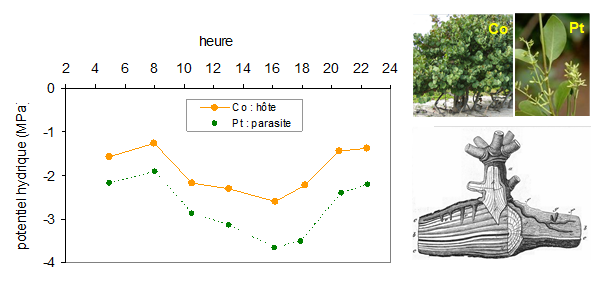
Une puissante chambre à dépression : le gui Le système hydraulique de la plante peut être parasité, par exemple par le gui (Viscum album) chez certains arbres, ou la cuscute (Cuscuta epilinum) sur le lin et d’autres espèces. Ces parasites parviennent à détourner une partie de la sève brute du xylème de l’hôte grâce à des organes spécialisés, les suçoirs et plusieurs adaptations physiologiques. Pour pomper la sève brute, le parasite doit être capable d’imposer un potentiel hydrique plus négatif que celui de l’hôte. C’est ce que l’on voit sur la Fig. 5 sur laquelle on peut faire deux observations. En premier lieu, les potentiels hydriques foliaires de l’hôte et de son parasite varient de façon parallèle dans la journée, avec, de façon classique, un maximum nocturne et un minimum aux heures chaudes. On note aussi un décalage systématique, de l’ordre de 1 MPa entre les deux plantes. Cette différence s’explique par une forte résistance hydraulique au transfert de l’eau entre les deux végétaux, probablement localisée au niveau des connexions entre les suçoirs du parasite et la portion de branche ou de tronc dans laquelle ils sont accrochés. Enfin, contrairement à la plupart des plantes vasculaires, ces deux espèces sont caractérisées par une forte concentration saline de leur sève brute (en ions Na, Ca, K, Mg), ce qui explique les faibles valeurs de leurs potentiels de base, qui restent très négatifs même la nuit en l’absence de transpiration. |
|
Figure 5. Evolution du potentiel hydrique de feuilles d’un arbre de mangrove (Coccoloba uvifera, photo Co) et de celles de son parasite (Pthirusa maritima, photo Pt) espèce proche du gui, sur la côte du Venezuela. Le potentiel hydrique foliaire est mesuré au moyen d’une chambre à pression (repris de Goldstein et al., 1989). Le dessin en bas à droite du cadre représente l’implantation en coupe longitudinale du parasite dans les tissus de l’hôte, avec ses différents suçoirs (Sachs, 1887). |
3.3. Capacitance hydraulique : mesures sur des feuilles
La capacitance hydraulique, qui est la relation entre potentiel hydrique et teneur en eau, fait l’objet de mesures au laboratoire, notamment sur les feuilles. C’est la technique des courbes pression-volume (voir Tyree et Hammel, 1972 ; Dreyer et al., 1990) dans laquelle l’opérateur mesure simultanément le potentiel hydrique (à la chambre à pression par exemple) et sa teneur en eau, obtenue par pesée. Entre deux mesures, l’échantillon est desséché, soit en le laissant librement perdre de l’eau sur la paillasse du laboratoire, soit en utilisant une chambre à pression. Ces courbes pression-volume font l’objet de développements dans le chapitre II.1 qui explicite le mode opératoire. Cette méthodologie donne accès pour différents degrés de TER aux deux principales composantes du potentiel hydrique d’un tissu, le potentiel de turgescence et le potentiel osmotique, ainsi que sa capacitance hydraulique.
Quelques compléments aux PARAGRAPHES 2 & 3
La détermination de la TER nécessite de porter l’échantillon à la pleine turgescence. L’analyse des trois principales sources d’erreur pouvant fausser les résultats de cette technique va nous permettre de mettre en évidence trois phénomènes physiologiques qu’il est bon de connaître (Čatsky 1960, Barrs et Weatherley 1962).
· En l’absence de lumière, un organe vivant continue de respirer, c'est-à-dire de libérer du CO2 en consommant des sucres ; ceci se traduit par une baisse du poids sec de l’échantillon (lequel est supposé rester constant) pendant une réhydratation en absence de lumière. En réglant l’intensité lumineuse approximativement au point de compensation pour la lumière [1] (pour qu’une faible photosynthèse subsiste et compense la respiration des tissus), on supprime ce phénomène.
· L’absorption de croissance. Elle se manifeste par la persistance, après que la pleine turgescence ait été atteinte, d’une augmentation de poids. Cette absorption résulte de la croissance en volume ainsi qu’en poids sec des cellules de l’échantillon. Ce phénomène se produit surtout sur des feuilles jeunes, et sous une intensité lumineuse suffisante. Ainsi, au lieu d’un palier de saturation, on observe une augmentation continuelle parfois prolongée du poids de l’échantillon. Pour atténuer ce phénomène d’une façon efficace, il faut réhydrater l’échantillon à une température de 3-5°C environ.
· La sursaturation. Normalement, en conditions physiologiques normales, les espaces intercellulaires d’une feuille sont remplis d’air. Mais dans certaines conditions, en particulier si on plonge dans de l’eau une feuille ou un disque foliaire, ces espaces peuvent se remplir d’eau. On parle d’injection des espaces intercellulaires. Comme ceux-là occupent un volume non négligeable de la feuille, on peut aboutir à l’absorption d’un volume d’eau supérieur à celui correspondant à la pleine turgescence, ne correspondant pas à un état physiologique normal. L’intensité de ce phénomène est très variable d’une espèce à l’autre, très faible par exemple chez Ricinus communis, important chez Sambucus nigra.
Enfin il faut se souvenir que la pleine turgescence, qui correspond à = 0, est plutôt un état limite dont on se rapproche plus ou moins. Un échantillon végétal n’est pas identique à un échantillon artificiel homogène. C’est un milieu vivant, qui évolue donc dans le temps, hétérogène dans sa composition, siège de réactions biochimiques continuelles et dont le comportement vis-à-vis de l’eau ne peut, qu’en première approximation et sous certaines conditions, être assimilé à celui d’un compartiment homogène et inerte.
Ainsi, il n’est pas toujours possible d’atteindre la pleine turgescence, même sur des feuilles ou des petites tiges feuillées, qui sont pourtant les échantillons se prêtant le mieux à ces mesures. D’autres organes, comme les fruits, ou des taxons comme les cactées, ne peuvent être portés à la pleine turgescence, soit du fait de la durée du processus, soit du fait du pourrissement des tissus qui l’accompagne.
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU