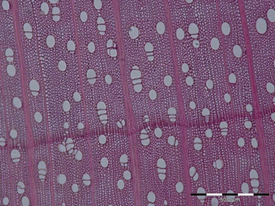
Anatomie des éléments du système vasculaire des plantes
3.1. La paroi d’une cellule du xylème
3.1.1. Une structure multicouche
Les principaux constituants chimiques de la paroi d’une cellule de bois sont la cellulose, les hémicelluloses et la lignine.
La cellulose forme des microfibrilles, c’est-à-dire de faisceaux de molécules liées entre elles par des liaisons hydrogène. Les microfibrilles, d’un diamètre compris entre 10 et 20 nm, présentent des zones cristallines (micelles) et des zones amorphes. Les hémicelluloses sont étroitement associées à la cellulose et assurent les liaisons chimiques entre l’armature de cellulose et la matrice de lignine. La lignine forme avec les hémicelluloses une matrice autour des microfibrilles de cellulose. Déposée en dernier lors de la différenciation cellulaire, elle comble les espaces vides de la paroi. Dans la paroi primaire les fibrilles de cellulose ne sont pas disposées de manière aussi régulière que dans la paroi secondaire, il y a donc plus de vides, et proportionnellement à son épaisseur, la paroi primaire est plus lignifiée que la paroi secondaire. La pectine, polysaccharide (= polymère de sucres) proche des hémicelluloses est le principal constituant de la lamelle moyenne des cellules végétales non ligneuses. Dans le cas du bois, la pectine est un constituant mineur, rarement évoqué.
Les différentes couches de la paroi sont la lamelle moyenne, la paroi primaire et la paroi secondaire (Fig. 3).
La lamelle moyenne colle les cellules entre elles. Elle est non fibrillaire, ce qui signifie qu’elle ne contient pas de cellulose. Dans le bois, son principal composant est la lignine.
La paroi primaire est celle avec laquelle la cellule naît. Lorsque la cellule-mère se divise, chacune des cellules-filles hérite d’une grande partie de la paroi primaire maternelle. Dans la paroi primaire, les microfibrilles de cellulose forment un réseau lâche extensible, compatible avec la croissance cellulaire. Les cellules nouvellement formées possèdent donc uniquement une paroi primaire qui va pouvoir supporter la première étape de la différenciation cellulaire, à savoir la croissance. A la fin de la différenciation, la paroi primaire est fortement lignifiée.
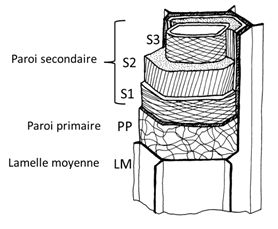
Figure 3. Structure multicouche de la paroi d’une cellule de bois
La paroi secondaire est synthétisée par la cellule lorsqu’elle a atteint ses dimensions finales (Fig. 4).
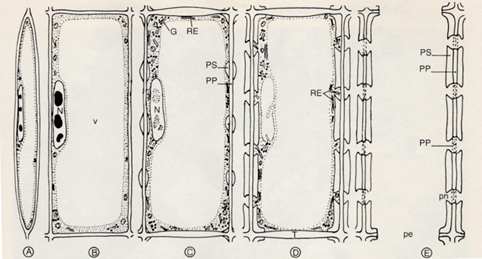
Figure 4. Différenciation d’un élément de vaisseau[1]
A : cellule cambiale
B : accroissement du volume cellulaire et nucléaire (v : vacuole)
C : début de la formation des épaississements secondaires (PS) (PP : paroi primaire, G : appareil de Golgi,
RE : réticulum endoplasmique)
D : paroi secondaire en cours de lignification
E : élément de vaisseau différencié (pn : ponctuation, pe : perforation)
Dans la paroi secondaire, les fibrilles de cellulose sont enroulées en hélices régulières. On distingue 3 couches (Fig. 3) : S1, S2 et S3.
-S1 est au contact de la paroi primaire. Les fibrilles de cellulose sont presque horizontales avec changement du sens d’enroulement (en forme de S et de Z).
-S2 est la couche la plus épaisse (plusieurs microns). Les fibrilles de cellulose sont presque verticales, et toutes parallèles (un seul sens d’enroulement). Cette couche étant la plus épaisse, son influence sur les propriétés physiques et mécaniques du bois est primordiale. Le AMF (angle de microfibrilles) ou MFA (en anglais : « MicroFibril Angle ») dont il est question dans de nombreuses publications est généralement celui de S2.
- S3 est similaire à S1. C’est la dernière couche déposée, celle qui est au contact de la sève brute et celle que l’on voit lorsqu’on observe l’intérieur de la cellule. Elle peut porter des épaississements spiralés parfois assimilés à une couche S4 (Fig. 5). Présents chez certaines espèces, plus souvent dans les éléments conducteurs de faible diamètre des bois des régions tempérées, ils amélioreraient la mouillabilité de la sève et limiteraient le risque d’apparition de microbulles de gaz.[2] Ces épaississements spiralés dans les vaisseaux ponctués du xylème secondaire ne doivent pas être confondus avec les vaisseaux spiralés du xylème primaire (voir plus loin).

Figure 5. Epaississements spiralés dans des vaisseaux de houx (Ilex crenata) (photo : Marie-Christine Trouy-Jacquemet)
3.1.2. Répartition des constituants structuraux dans la paroi cellulaire
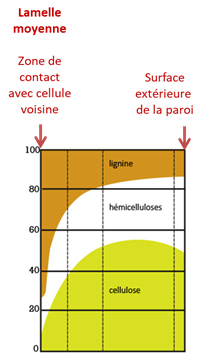
La répartition des constituants chimiques dans la paroi peut être mise en relation avec leurs propriétés moléculaires (Fig. 6) :
- Les constituants les plus hydrophiles de la paroi sont les hémicelluloses et leur teneur est plus importante au niveau de la zone de contact avec la sève afin de favoriser l’adhésion.
- La lignine contribue à rigidifier la paroi pour limiter le risque d’implosion sous l’effet des fortes tensions (i.e. des pressions négatives) créées par la transpiration, moteur de la montée de sève. Comme c’est un constituant hydrophobe, sa plus faible teneur en surface est favorable pour garantir une bonne adhésion de la sève à la paroi. Enfin, la lignine est une colle naturelle, ce qui explique qu’elle soit le principal constituant du ciment intercellulaire que constitue la lamelle moyenne.
|
Figure 6 : Distribution en pourcentages de la lignine, des hémicelluloses et de la cellulose à l’intérieur de la paroi d’une cellule de bois de résineux [3]
|
|
3.1.3. Ponctuations
Sur les parois des éléments vasculaires, au niveau de zones circulaires appelées ponctuations, la paroi secondaire n’est pas déposée et, non seulement la lamelle moyenne et la paroi primaire ne sont pas lignifiées, mais elles sont partiellement hydrolysées et forment la membrane de la ponctuation (Fig. 4E). Observée de face, cette membrane de ponctuation peut ressembler à un filet, structure caractéristique de l’armature cellulosique de la paroi primaire. Entre deux trachéides ou deux vaisseaux accolés latéralement, la sève brute pourra circuler de l’un à l’autre en passant « entre les mailles du filet ».
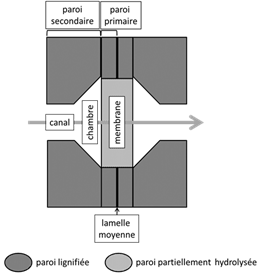
Dans le cas des résineux, la sève brute passe d’une trachéide à l’autre par des ponctuations dites aréolées, car elles présentent une forme d’auréole ou d’aréole lorsqu’on les regarde de face, sur une coupe radiale (Fig. 7).
Au niveau de la ponctuation, pour chacune des deux trachéides, la paroi secondaire est percée et souvent décollée. Elle peut être comparée à un petit cratère. Au centre de la ponctuation, la paroi primaire est épaissie pour former un disque lenticulaire appelé torus. Autour du torus, se trouve la marge de la ponctuation : la paroi primaire y est partiellement hydrolysée et réduite à un réseau lâche de fibrilles de cellulose. Les espaces, ménagés entre les fibrilles de cellulose et permettant le passage de la sève, sont désignés sous le nom de pores.
Le torus entouré de la marge forme la membrane de la ponctuation. C’est une partie « libre » de la paroi primaire (en réalité les parois primaires des deux cellules voisines collées entre elles par la lamelle moyenne), c’est-à-dire non recouverte de paroi secondaire. La membrane est mobile car la marge est extensible.
L’espace intérieur de la ponctuation est la chambre.
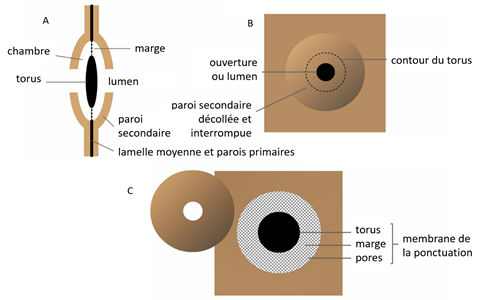
Figure 7. Représentation schématique d’une ponctuation aréolée : en A sur une coupe tangentielle, en B et C sur une coupe radiale. En C, la paroi secondaire est enlevée, tel un couvercle, pour montrer la paroi primaire sous-jacente[4].
Les ponctuations aréolées peuvent être comparées à de petites valves qui sont susceptibles de se fermer de façon plus ou moins irréversible. Ce phénomène est une réponse à l’embolie. La fermeture est obtenue par aspiration du torus qui vient se plaquer contre la paroi secondaire de la trachéide qui l’a aspiré, et en obture l’ouverture (Fig. 8, voir aussi paragraphe 3.3.4).
Dans le cas des feuillus, une paroi commune entre deux vaisseaux accolés porte des ponctuations intravasculaires aréolées, généralement sans torus (Fig. 9, 10 et 11).
|
|
|
|
Figure 8. Coupe radiale de douglas (MEB). Dans la trachéide de droite, les torus sont visibles à travers les lumens des ponctuations car ils ont été aspirés ; les épaississements spiralés sont présents (photo : M.-C. Trouy-Jacquemet) |
Figure 9. Ponctuation aréolée de feuillu. La flèche montre le parcours de la sève. |
La paroi secondaire n’est pas (ou peu) décollée. L’aréole, dessinée par les deux cercles concentriques que forment le contour de la chambre et l’ouverture de la ponctuation, n’est visible que par transparence en microscopie photonique (Fig. 10B).
|
A |
B |
Figure 10. Bois de peuplier. A : coupe transversale montrant des vaisseaux solitaires et des vaisseaux accolés ; B : coupe tangentielle montrant les ponctuations intravasculaires alternées (photos de Marie-Christine Trouy-Jacquemet)
En microscopie électronique à balayage, une paroi intacte ne montre que les lumens de ponctuation ; le caractère aréolé qui traduit la présence d’une chambre n’est observable que si la paroi est déchirée pour laisser apparaître le contour des chambres (Fig. 11B).
|
A
|
B
|
Figure 11. Bois d’érable. A : coupe longitudinale-radiale montrant des vaisseaux accolés dans la direction radiale ; B : coupe longitudinale-tangentielle montrant de face une paroi partiellement déchirée permettant de voir des ponctuations intravasculaires à différents niveaux de profondeur (les épaississements spiralés sont présents) (photos de Marie-Christine Trouy-Jacquemet)
3.1.4. Perforations
Les vaisseaux, éléments conducteurs spécifiques des feuillus, sont construits par empilement d’éléments de vaisseau, un élément de vaisseau étant une cellule formée par une fusiforme cambiale, dont il conserve généralement la longueur. La particularité d’un élément de vaisseau est d’être perforé à ses extrémités (Fig. 12).
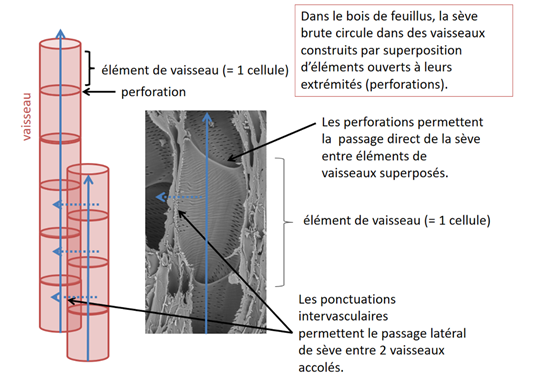
Figure 12. Perforations et ponctuations dans les vaisseaux
Selon le degré d’évolution du bois (voir paragraphe 3.5.1), les éléments de vaisseaux se chevauchent au niveau de leurs extrémités en biseau (comme les trachéides de résineux) ou alors ils s’empilent les uns sur les autres, comme des tonneaux. La zone de contact entre deux éléments d’un même vaisseau, qu’elle corresponde à un « chevauchement » ou à un « empilement », est perforée, au sens où, par endroit, la double cloison terminale a été résorbée. Les éléments de vaisseau se sont ouverts en regard l’un de l’autre au moment de la différenciation. La cloison perforée est visible de face sur une coupe longitudinale-radiale.
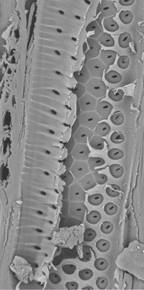
Si la cloison terminale est ouverte sous forme de plusieurs fentes oblongues, on parle de perforation scalariforme car la double cloison terminale subsiste sous forme de barres qui ne sont pas sans rappeler des barreaux d’échelle (Fig. 13).
Si la cloison terminale est perforée en une ouverture unique, on parle de perforation simple, ou unique (Fig. 11 et 12).

Figure 13. Perforation scalariforme sur une coupe longitudinale-radiale de bouleau (MEB). Photo de Marie-Christine Trouy-Jacquemet.
[1] Robert D Catesson AM (1990), Biologie végétale, tome 2 : organisation végétative, Doin
[2] Kohonen MM et Helland Å (2009) On the function of Wall Sculpturing in Xylem Conduits, 6, 324-329
[3] d’après Panshin et Zeeuw, Textbook of Wood Technology, 1980
[4] Trouy M.-C. (2015), Anatomie du bois : formation, fonctions et identification, Quae
3.2. Le xylème primaire
3.2.1. Différenciation dans la tige chez les Angiospermes dicotylédones
Au niveau des apex, le méristème apical est le siège de la prolifération cellulaire (mérèse). Plus bas dans la tige, les cellules méristématiques produites par le méristème apical s’organisent en trois méristèmes primaires : le protoderme, le procambium et le méristème fondamental (coupe AA de la figure 14).
Les cordons de procambium, une fois différenciés, forment des faisceaux conducteurs, qu’on appelle faisceaux libéro-ligneux (en référence au liber et au bois, même si ces noms désignent respectivement phloème et xylème secondaires) ou faisceaux cribro-vasculaires (en référence aux cellules conductrices de sève, les éléments de tubes criblés et les éléments de vaisseaux chez les feuillus). Chez les résineux (gymnospermes) et les feuillus (angiospermes dicotylédones), les faisceaux sont disposés en un cercle unique sur une coupe transversale. Les faisceaux de la tige se prolongent dans les feuilles à l’intérieur des nervures.
La jeune tige doit se doter de cellules conductrices de sève, à partir des cellules des cordons de procambium. Les premiers éléments de xylème primaire se différencient sur le bord interne des cordons, puis la différenciation progresse vers l’extérieur. La différenciation du xylème primaire de tige est donc centrifuge. Les premiers éléments de phloème primaire se différencient sur le bord externe des cordons, puis la différenciation progresse vers l’intérieur. La différenciation du phloème primaire de tige est donc centripète (coupe BB de la figure 14).
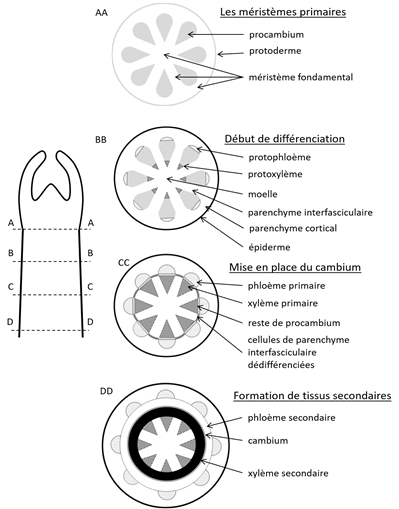
Figure 14. Différenciation des tissus primaires, mise en place du cambium et formation des tissus conducteurs secondaires dans la tige[1]
Le protoxylème et le protophloème sont les tout premiers éléments conducteurs qui apparaissent, lorsque l’élongation de la tige n’est pas achevée.
Le métaxylème et le métaphloème se différencient lorsque l’élongation de la tige est terminée et prennent le relais des éléments de protoxylème et de protophloème qui ont fini par être écrasés sous l’effet de l’élongation.
A l’intérieur des cordons de procambium, la différenciation du métaxylème progresse donc du centre vers la périphérie et la différenciation du métaphloème de la périphérie vers le centre. Mais ils ne se rencontrent jamais chez les végétaux qui forment du bois (les gymnospermes et les angiospermes dicotylédones). Ils restent séparés par des lames de procambium qui formeront une partie du cambium après avoir été reliés après dédifférenciation des cellules de parenchyme interfasciculaires qui les séparent (coupes CC et DD sur la figure 14).
En résumé, la structure primaire de la tige chez les Angiospermes dicotylédones a les caractéristiques suivantes :
- le xylème primaire et le phloème primaire sont superposés dans un faisceau
- la différenciation du xylème primaire est centrifuge
- la différenciation du phloème primaire est centripète
- les faisceaux sont disposés en cercle sur une coupe transversale- la différenciation n’épuise pas tout le procambium, qui subsiste sous forme de lames intrafasciculaires
- entre ces lames, des cellules de parenchyme interfasiculaire se dédifférencient pour former un cylindre complet de cambium
- un parenchyme à grosses cellules forme la moelle au centre de la tige
- sous l’épiderme, le parenchyme cortical est plutôt mince.
3.2.2. Différenciation dans la racine chez les Angiospermes dicotylédones
La structure primaire de la racine chez les Angiospermes dicotylédones a les caractéristiques suivantes (voir Fig. 15) :
- le xylème primaire et le phloème primaire sont alternés
- la différenciation du xylème primaire et celle du phloème primaire sont centripètes
- le cylindre de tissus conducteurs est entouré d’une assise parenchymateuse appelée péricycle, puis d’une autre qui joue le rôle de filtre : l’endoderme
- on ne peut pas parler de faisceaux
- la différenciation n’épuise pas tout le procambium, qui subsiste sous forme d’arcs dessinant une « étoile sans pointes »
- les cellules du péricycle qui se trouvent en face des pointes de protoxylème se dédifférencient pour former « les pointes de l’étoile » méristématique
- il n’y a pas de moelle
Le cambium racinaire, initialement en forme d’étoile, va peu à peu acquérir la forme circulaire de son homologue de la tige au fur et à mesure qu’il formera bois et liber.
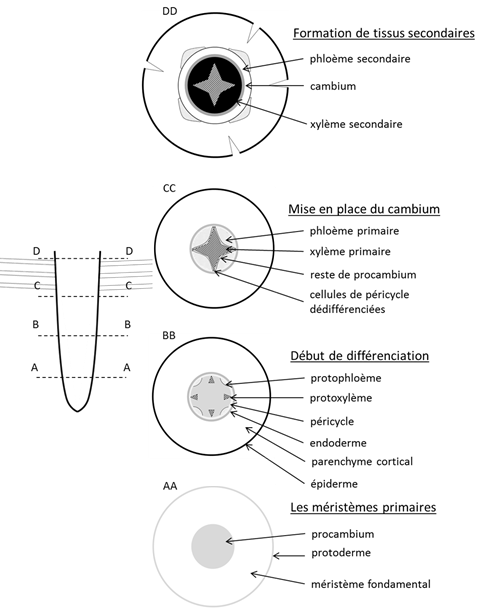
Figure 15. Différenciation des tissus primaires, mise en place du cambium et formation des tissus conducteurs secondaires dans la racine[2]
3.2.3. Protoxylème et métaxylème
Comme le protoxylème se différencie lorsque l’élongation de la tige n’est pas achevée, les cellules conductrices du protoxylème doivent être à la fois rigides et extensibles. L’épaississement et la lignification de la paroi sont partiels et se présentent sous forme d’anneaux ou de spirales : on parle de vaisseaux annelés et de vaisseaux spiralés (Fig. 16).
Les vaisseaux spiralés ne doivent pas être confondus avec les épaississements spiralés présents sur les parois de certaines cellules de bois, par exemple les trachéides de douglas (Fig. 8), les vaisseaux de houx (Fig. 5) ou d’érable (Fig. 11).
Entre les parties lignifiées, la paroi reste primaire et pecto-cellulosique, donc extensible. La cellule peut à la fois conduire la sève et supporter jusqu’à un certain point l’élongation de l’organe qui la contient.
Dans le métaxylème, les cellules ne subiront plus d’allongement, les épaississements lignifiés sont plus étendus, d’abord sous forme de rayures chez les vaisseaux rayés. Puis les rayures sont de plus en plus reliées les unes aux autres chez les vaisseaux réticulés. Enfin, la paroi est entièrement épaissie et lignifiée sauf au niveau des ponctuations chez les vaisseaux ponctués (Fig. 16).
Dans le xylème secondaire, c’est-à-dire le bois, formé par le cambium lors de la croissance en largeur, les vaisseaux sont tous des vaisseaux ponctués.
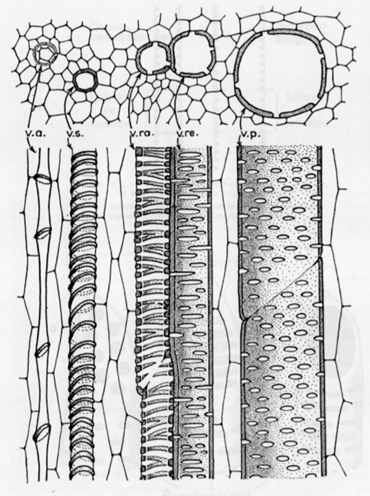
Figure 16. Vaisseaux ligneux de la tige de courge (v.a. : vaisseau annelé ; v.s. : vaisseau spiralé ; v.ra : vaisseau rayé ; v.re. : vaisseau réticulé ; v.p. : vaisseau ponctué)[3]
Les deux parties d’une feuille de cornouiller délicatement déchirée restent liées l’une à l’autre par des fils invisibles. L’observation de ces « fils » au MEB (microscope électronique à balayage) montre qu’il s’agit des vaisseaux spiralés présents au niveau des faisceaux conducteurs des nervures.
|
A |
B |
Figure 17. La feuille de cornouiller. A : les deux parties de la feuille semblent liées par des fils invisibles : B : les fils invisibles sont les vaisseaux spiralés présents au niveau des nervures (MEB) (photo : Marie-Christine Trouy-Jacquemet)
[1] Trouy M.-C. (2015), Anatomie du bois : formation, fonctions et identification, Quae
[2] Trouy M.-C. (2015), Anatomie du bois : formation, fonctions et identification, Quae
[3] Morphologie des végétaux vasculaires : cytologie, anatomie, adaptations (1972) Henri Camefort, Doin Editeurs
3.3. Le xylème secondaire - Généralités
Le cambium, mis en place à la fin de la première année de vie de la tige ou de la racine, forme chez les gymnospermes et les angiospermes dicotylédones pérennes, le xylème secondaire, ou bois, et le phloème secondaire, ou liber (coupe DD des figures 14 et 15).
Dans les régions tempérées, les arbres interrompent leur croissance en hiver car les conditions ne sont pas propices. La quantité de bois formé en an correspond à un cerne annuel.
L’aubier est constitué des cernes de bois les plus récemment formés. C’est la zone dans laquelle la sève circule. La densité de flux (DF) de sève n’y est en général pas constante avec la profondeur. Chez le chêne (sessile et pédonculé), on a un maximum de DF dans les quelques derniers cernes et plus en profondeur la DF décroît rapidement. Chez le douglas, le profil est parabolique, le maximum de DF est atteint au milieu de l’aubier. Outre sa fonction conductrice, l’aubier peut être défini comme la partie périphérique du bois dans laquelle les cellules de parenchyme sont vivantes. Plus en profondeur, les cellules de parenchyme meurent. La partie centrale du bois, dans laquelle toutes les cellules sont mortes, est appelé duramen ou bois parfait, le terme « parfait » devant être compris comme « accompli », « ayant atteint la fin de son évolution normale », comme un « insecte parfait » est un insecte adulte ayant subi toutes ses métamorphoses.
Chez de nombreuses espèces, les cellules de parenchyme, avant de mourir, élaborent, à partir de leurs réserves d’amidon, des substances qui vont imprégner le bois et modifier ses propriétés. Ce sont des métabolites secondaires qu’on qualifie d’extractibles car ils peuvent être extraits du bois par des solvants.
Les thylles correspondent à des excroissances des cellules de parenchyme radial ou longitudinal à l’intérieur d’un vaisseau (Fig. 18). Le thylle peut se former à travers une ponctuation si son diamètre est supérieur à 10 μm, au moment de la duraminisation (évolution vers le duramen) ou d’un traumatisme. Dans ce dernier cas, on parle de thylles traumatiques, formés dans l’aubier suite à une blessure, une maladie, ou simplement l’abattage de l’arbre.

Figure 18. Production de thylles par les cellules de parenchyme radial dans un vaisseau de robinier (Robinia pseudoacacia) (coupe longitudinale-radiale) (photo : Marie-Christine Trouy-Jacquemet)
Lorsque les ponctuations entre vaisseau et parenchyme sont petites, il n’y a pas formation de thylles mais parfois de gommes, c’est-à-dire de substances élaborées par le parenchyme et sécrétées à l’intérieur du vaisseau qui est alors obstrué (Fig. 19).
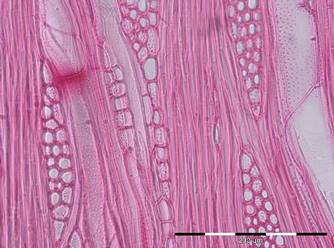
Figure 19. Production de gommes par les cellules de parenchyme radial dans un vaisseau de merisier (Prunus avium). Coupe longitudinale-tangentielle) (photo : Marie-Christine Trouy-Jacquemet)
3.4. Le xylème secondaire des conifères
Le xylème secondaire des conifères est ce qu’on appelle couramment le bois de résineux. Il est caractérisé par l’absence de vaisseaux (Fig. 20). Les conifères sont des gymnospermes, c’est-à-dire des végétaux dont les graines sont nues. D’autres gymnospermes produisent du bois, avec ou sans vaisseaux :
- Ginkgophytes : bois sans vaisseaux
- Cycadophytes : bois sans vaisseaux
- Gnétophytes : bois avec vaisseaux
Le bois de résineux n’est donc pas produit par tous les gymnospermes mais par une partie d’entre eux.
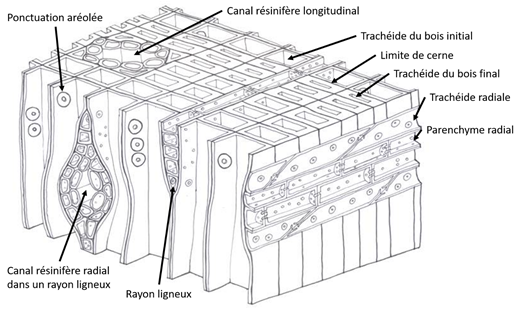
Figure 20. Représentation schématique d’un bois de résineux[1]
3.4.1. Les trachéides
Une trachéide est une cellule allongée issue d’une cellule initiale fusiforme du cambium. C’est une cellule morte dont ne subsiste plus que la paroi. Elle remplit à la fois un rôle de conduction de la sève brute et de soutien mécanique. Elle mesure en moyenne 3 mm de long et porte à ses extrémités, sur les parois radiales, des ponctuations aréolées. Les trachéides se chevauchent au niveau des extrémités, les ponctuations permettant la communication et donc le passage de la sève brute d’une trachéide à l’autre.
3.4.2. Les autres cellules
Les rayons ligneux sont constitués de cellules de parenchyme radial, vivantes dans l’aubier, parfois associées chez certains résineux à de petites trachéides radiales (mortes). Comme les cellules de parenchyme longitudinal, elles ont plusieurs fonctions, dont le stockage de réserve ou l’élaboration de substances de défense ou de compartimentation. Les rayons ligneux se prolongent dans le liber sous forme de rayons libériens ; ils sont donc directement « branchés » sur le flux libérien de sève élaborée, et leur orientation leur permet de transporter radialement les sucres, notamment jusqu’aux cellules de parenchyme longitudinal. Leur rôle est donc davantage en lien avec la sève élaborée qu’avec la sève brute.
Les cellules bordant les canaux résinifères constituent un cas particulier de cellules de parenchyme spécialisées dans la sécrétion de résine. Les canaux résinifères, à la fois longitudinaux et radiaux, sont toujours présents dans 4 genres : Pinus (pins), Pseudotsuga (douglas), Picea (épicéas) et Larix (mélèzes). Ils sont normalement absents dans le bois des autres genres par exemple le genre Abies (sapins, Fig. 21) mais peuvent être formés par le cambium suite à un traumatisme (poche de résine).
3.4.3. Bois initial/bois final
Dans les régions tempérées, le cambium ne forme pas des trachéides identiques tout au long de la saison de végétation. Les trachéides formées au printemps sont de section carrée (de l’ordre de 30µm x 30µm) et à parois minces ; elles peuvent conduire de grandes quantités de sève pour répondre aux besoins importants de l’arbre au moment de la reprise d’activité.
Les trachéides formées en été et en automne sont de section rectangulaire (de l’ordre de 30µm x 10µm) et à parois épaisses. Elles jouent nettement, en plus du rôle de conduction de la sève, un rôle de soutien mécanique de l’arbre.
La limite de cerne est toujours brutale dans les résineux des régions tempérées car elle sépare les cellules aux sections les plus étroites et aux parois les plus épaisses (les dernières cellules formées par le cambium à la fin de la saison de végétation) des cellules aux sections les plus grandes et aux parois les plus fines (les premières cellules formées par le cambium l’année suivante) (Fig. 21).
|
|
|
Figure 21. Coupes transversales de bois de sapin (Abies alba). Photo : Marie-Christine Trouy-Jacquemet.
3.4.4. Embolie estivale (voir aussi Chap. II.7)
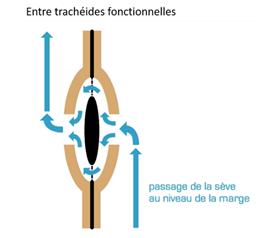
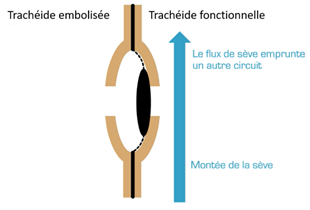
La cavitation est la rupture brutale d’une colonne de sève brute. Elle est suivie par l’embolie, c’est-à-dire la croissance d’une cavité gazeuse (air + vapeur d’eau). L’embolie estivale se développe lorsque le potentiel hydrique diminue au-dessous d’un certain seuil (i.e. existence d’une forte tension dans les éléments conducteurs). Cette situation est en général atteinte en été lorsque le sol s’est fortement desséché et que l’arbre continue de transpirer (stomates non totalement fermés). Cet état de tension à l’intérieur des éléments conducteurs va provoquer le passage de l’air des éléments déjà embolisés, naturellement (on a montré qu’il en existait toujours au moins quelques-uns) ou accidentellement lorsqu’il y a cavitation de la colonne d’eau, vers les éléments sains sous forme de germes d’air, et propager ainsi l’embolie via les ponctuations des trachéides. La sève brute est alors « aspirée » au niveau des feuilles. Lorsqu’une trachéide est fonctionnelle, sa pression interne est inférieure à la pression atmosphérique. Lorsqu’une trachéide est embolisée, elle est à la pression atmosphérique : les ponctuations qui la séparent de ses voisines fonctionnelles vont alors se fermer par aspiration des torus par ces dernières (Fig. 22). La trachéide embolisée est ainsi isolée et le risque de propagation de l’embolie est limité. Il s’agit d’un phénomène purement mécanique, comme une porte qui claque. Les trachéides étant des cellules mortes, la fermeture des ponctuations aréolées ne fait intervenir aucun phénomène biologique.
L’embolie et la fermeture des ponctuations aréolées sont des événements normaux et courants chez les résineux, qui sont compensés par le fait que les cellules conductrices sont nombreuses et que l’arbre se dote chaque année d’un nouveau cerne de cellules conductrices.
|
A |
C
|
|
B |
Figure 22. Ponctuations aréolées de résineux. A : passage de la sève au niveau d’une ponctuation aréolée entre deux trachéides fonctionnelles ; B : en cas d’embolie, le torus est aspiré et vient se bloquer contre le lumen de la ponctuation du côté de la trachéide fonctionnelle ; C : représentation schématique d’une coupe tangentielle de bois de résineux avec une trachéide embolisée (repérée par une croix et l’absence de flèche) et des trachéides fonctionnelles (Tyree et Zimmermann, 1983)[2]
3.4.5. Embolie hivernale
L’embolie hivernale est due au cycle gel-dégel de la sève brute, la formation de bulles étant une conséquence de la non solubilité de l’air dans la glace.
Le système conducteur des résineux est très compartimenté puisque les trachéides sont des cellules non perforées, dans lesquelles la sève circule en traversant sans arrêt de nombreuses ponctuations aréolées.
Cette compartimentation, bien qu’augmentant la résistance hydraulique, est favorable à la limitation de la propagation des embolies. En cas de gel, les petites bulles formées ne se transmettent pas de trachéide à trachéide, ce qui limite le risque de formation de grosses bulles par coalescence. Les petites bulles sont plus rapidement résorbées lors du dégel que les grosses.
Lorsqu’on compare les bois de résineux entre eux, le diamètre des trachéides apparaît comme le trait déterminant de la résistance à l’embolie hivernale[3].
[1] Trouy M.-C. (2015), Anatomie du bois : formation, fonctions et identification, Quae
[2] Tyree MT et Zimmermann MH (2002) Xylem Structure and the Ascent of Sap, Springer
[3] Pittermann J et Sperry J (2003) Tracheid diameter is the key trait determining the extent of freezing-induced embolism in conifers, Tree Physiology, 23, 907-914
3.5. Le bois des feuillus
Le bois de feuillus est produit par les Angiospermes dicotylédones pérennes. Il est caractérisé par la présence de vaisseaux (Fig. 23), ce qui le différencie très nettement du bois formé par les conifères.
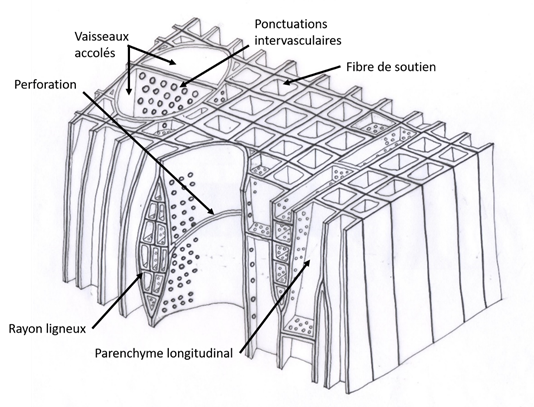
Figure 23. Représentation schématique d’un bois de feuillu
3.5.1. Les vaisseaux
Les vaisseaux sont construits par empilement d’éléments de vaisseau, un élément de vaisseau étant une cellule perforée à ses extrémités.
Un vaisseau pris individuellement n’est pas continu des racines jusqu’aux feuilles, il présente des extrémités sous forme d’éléments de vaisseaux terminaux effilés. Cependant, un vaisseau ne peut se terminer sans être accolé à un autre vaisseau pour assurer la continuité de la montée de sève brute.
Les vaisseaux ne forment pas des tubes parfaitement droits et verticaux à l’intérieur du bois, mais un réseau de tuyaux présentant des inclinaisons, voire même des ondulations, parfois solitaires, parfois regroupés, se séparant et se regroupant sans cesse le long de leur tracé pseudo-vertical (Fig. 24).
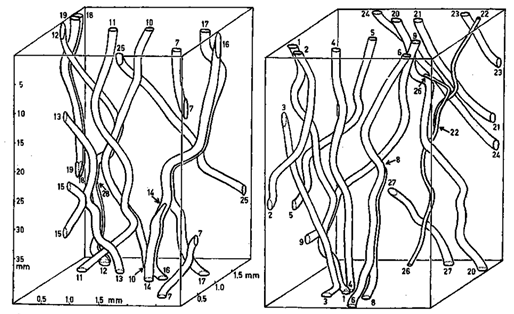
Figure 24. Parcours des vaisseaux dans une pièce de bois de Cedrela fissilis. Les vaisseaux individuels ont été arbitrairement séparés en deux blocs pour plus de clarté. Les vaisseaux sont numérotés là où ils émergent du bloc. Les flèches montrent des fins de vaisseaux. L’échelle axiale a été raccourcie 10 fois [1]
Alors que les trachéides sont des cellules non perforées dans lesquelles le parcours de la sève brute impose la traversée de ponctuations aréolées, les vaisseaux sont de longs tubes offrant moins d’obstacles à la sève.
La résistance hydraulique est une grandeur caractérisant une conduite et permettant de calculer la perte de charge subie par un fluide s'écoulant dans la conduite. Les vaisseaux présentent une plus faible résistance hydraulique que les trachéides.
Cependant, un système compartimenté est plus sûr vis à vis de l’embolie en bloquant les bulles d’air.
L’évolution du bois s’est faite dans le sens d’une diminution de la résistance hydraulique couplé à une plus grande vulnérabilité vis-à-vis de l’embolie :
- Augmentation du diamètre des éléments de vaisseaux pour limiter les forces de frottement (couplé à une réduction de la hauteur)
- Evolution d’une perforation scalariforme vers une perforation simple
- Augmentation de la longueur des vaisseaux pour limiter le nombre d’éléments de vaisseaux terminaux
Pour pallier cette vulnérabilité, la plante peut adopter différentes stratégies, comme former un système conducteur redondant et diversifier son système conducteur avec des vaisseaux de différentes tailles et des trachéides, ou encore réparer les embolies par des pressions positives via la poussée racinaire. Le parenchyme associé aux vaisseaux joue un rôle important dans l’évitement et la réparation des embolies. Le rôle des fibres ne se limiterait pas au soutien et pourrait avoir trait dans une certaine mesure à la fonction de conduction.
L’implication de ces différentes cellules dans la conduction est évoquée dans les paragraphes suivants.
3.5.2. Les trachéides des feuillus
Les trachéides vasculaires sont associées à de petits éléments de vaisseaux et ne s’en distinguent que par l’absence de perforation à leurs extrémités. Comme les éléments de vaisseaux, elles forment des séries longitudinales. Les ponctuations aréolées sont identiques pour ces deux types de cellules. On les trouve par exemple au niveau du bois final d’orme ou de robinier.
Les trachéides juxtavasculaires ou vasicentriques sont des cellules courtes, de forme irrégulière, avec des extrémités en doigts de gant comme les trachéides de résineux. Elles sont souvent associées à des vaisseaux solitaires à diamètre plutôt large, par exemple les gros vaisseaux de la zone initiale poreuse du chêne et du châtaignier (Fig. 25). Leurs parois latérales comportent de nombreuses ponctuations aréolées espacées. Sur une coupe transversale, on ne les distingue pas des cellules de parenchyme longitudinal.
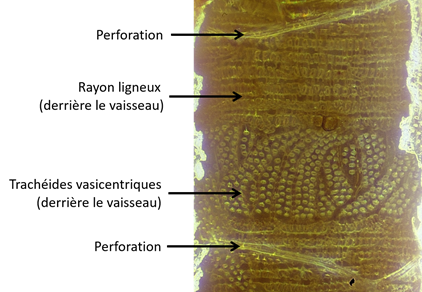
Figure 25. Coupe longitudinale-radiale de chêne rouge d’Amérique (Quercus rubra). Les zones de ponctuations visibles à l’intérieur du vaisseau dessinent le contour des cellules sous-jacentes (photo Jean-Claude Cerre).
3.5.3. Le parenchyme associé aux vaisseaux
Le parenchyme ligneux désigne l’ensemble des cellules vivantes présentes dans le bois. Il peut être longitudinal ou radial (rayons ligneux). On attribue à ce tissu les fonctions de stockage de carbohydrates non structuraux (principalement des sucres) et de défense (synthèse d’extractibles, formation de thylles, de gommes, au moment de la duraminisation ou de la compartimentation de blessures).
Les cellules de parenchyme longitudinal associées aux vaisseaux, en particulier, remplissent de multiples fonctions, certaines ayant trait avec la fonction de conduction des vaisseaux[2] :
- Evitement et réparation des embolies
- Transfert d’eau grâce à des aquaporines
- Interactions xylème/phloème et apoplaste/symplaste
- Modification de la composition ionique et du pH de la sève brute
- Production de surfactants
- Osmorégulation
Aujourd’hui, il semble dépassé de considérer le système conducteur de sève brute uniquement comme un ensemble de cellules mortes dont il ne subsiste plus que la paroi. C’est en réalité un système complexe impliquant des cellules mortes et des cellules vivantes.
Le parenchyme est particulièrement abondant chez les bois tropicaux aux vaisseaux de gros diamètre comme l’amarante (Fig. 26).

Figure 26. Coupe transversale d’amarante ou pao roxo (Peltogyne venosa). Le parenchyme longitudinal est paratrachéal (= associé aux vaisseaux) aliforme (il s’étend sous forme d’ailes de part et d’autre du vaisseau), confluent par endroits (les « ailes » se rejoignent d’un vaisseau à l’autre) ; les rayons ligneux apparaissent sous forme de lignes claires et les fibres de soutien composent le tissu de remplissage sombre et compact (photo : Marie-Christine Trouy-Jacquemet)
Les cellules de parenchyme communiquent entre elles grâce à des ponctuations simples avec plasmodesmes qui permettent le passage passif des substances par voie symplastique.
Les cellules de parenchyme communiquent avec les vaisseaux grâce à des ponctuations semi-aréolées (simple côté parenchyme et aréolée côté vaisseau) qui permettent le passage du symplaste à l’apoplaste. Les ponctuations portées par les cellules mortes n’ont pas de plasmodesmes.
La figure 27 est une représentation schématique de la libération de sucre dans un vaisseau impliquant ces deux types de ponctuation.
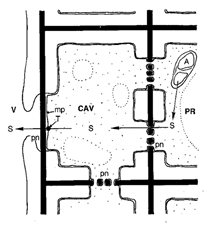
Figure 27. Libération de sucre dans un vaisseau. V : vaisseau ; CAV : cellule associée aux vaisseaux ; PR : parenchyme de réserve ; pn : ponctuation ; mp : membrane plasmique ; A : amidon ; S : saccharose[3]
3.5.4. Les fibres
Les fibres sont des cellules aux parois épaisses et au lumen (l’espace intérieur) réduit, portant des ponctuations simples, plus ou moins réduites. Elles assurent en grande partie le soutien mécanique de l’arbre.
Des parois de fibres épaisses pourraient jouer un rôle dans la sécurisation du système vasculaire vis-à-vis des risques liés à une trop forte tension de sève (Fig. 28)[4].
D’une part une paroi épaisse de fibre renforce mécaniquement la double paroi commune avec le vaisseau soumis à une forte tension, ce qui limite le risque d’implosion (a1). L’épaisseur de la paroi de la fibre adjacente au vaisseau prévient aussi le risque de déformation de celle-ci et la formation de germes d’air depuis la fibre, à travers des microfissures (b2). L’épaisseur de la paroi entre vaisseaux prévient également le risque d’implosion et l’apparition de germe d’air en limitant la déformation de la ponctuation, l’étirement de sa membrane et l’élargissement de ses pores favorable à la formation de germe d’air (b1).
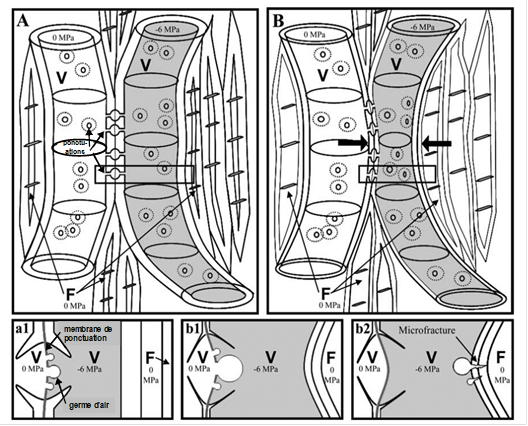
Figure 28. Rôle des fibres dans le risque d’embolie estivale des vaisseaux
3.5.5. Bois initial/bois final
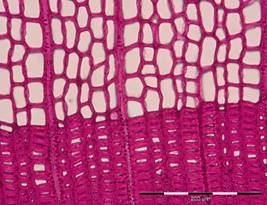
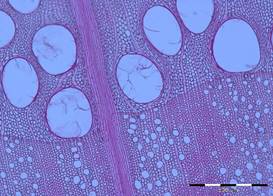
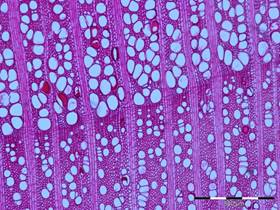
La différence de porosité entre le bois initial et le bois final permet de classer les feuillus en 3 catégories (Fig. 29) :
- Les feuillus à zone initiale poreuse présentent en début de cerne une concentration de vaisseaux beaucoup plus gros que les vaisseaux du bois final (Fig. 29A).
- Les feuillus à zone semi-poreuse montrent une nette évolution de la taille des vaisseaux à l’intérieur du cerne (Fig. 29B).
- Les feuillus à pores diffus, appelés également feuillus homogènes, se distinguent par une répartition uniforme des vaisseaux et peu de différences au niveau des diamètres tangentiels de pores (Fig. 29 et D). Pour les feuillus à pores diffus ayant crû en région tempérée, où la croissance est arrêtée en hiver, il est possible de distinguer les cernes grâce à la présence d’une limite de cerne, marquée par une légère différence entre le bois formé à la fin de cerne et celui formé au début, ou quelques couches de cellules différentes, par exemple des fibres aplaties radialement (Fig. 29C).
|
|
|
|
A : Un feuillu à zone initiale poreuse : le chêne sessile (Quercus petraea) |
B : Un feuillu à zone semi-poreuse : le merisier (Prunus avium) |
|
|
|
|
C : Un feuillu homogène à pores diffus : l’érable (Acer pseudoplatanus) |
D : Un feuillu homogène tropical : le tauari (Couratari spp.) |
Figure 29. Exemples de bois de feuillus (coupes transversales). Photos : Marie-Christine Trouy-Jacquemet.
3.5.6. Embolie estivale
Comme cela a été décrit au § 3.4.4, l’embolie estivale apparaît lorsque le potentiel hydrique diminue au-dessous d’un seuil critique, sur un sol fortement desséché, alors que l’arbre continue de transpirer. La tension à l’intérieur des éléments conducteurs provoque alors le passage de l’air à partir des éléments déjà embolisés et propager ainsi l’embolie (Fig. 30).
En conditions normales, les ponctuations sont capables à la fois de laisser passer l’eau entre deux éléments fonctionnels et d’empêcher le passage de l’air entre un élément embolisé et un élément fonctionnel. Contrairement aux conifères, chez les feuillus, il n’y a généralement pas de torus, donc pas de fermeture possible comme chez les résineux, mais la membrane de la ponctuation a des pores suffisamment petits pour répondre au même dilemme « l’eau oui, l’air non », du moins tant que les conditions restent supportables.
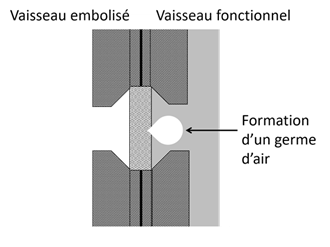
Figure 30. Formation d’un germe d’air à travers la membrane d’une ponctuation aréolée entre un vaisseau embolisé, à droite, et un vaisseau fonctionnel, à gauche.
La pression à l’intérieur des cellules conductrices fonctionnelles est toujours négative mais, en conditions normales, les ponctuations sont capables à la fois de laisser passer l’eau entre deux éléments fonctionnels et d’empêcher le passage de l’air entre un élément embolisé et un élément fonctionnel. Chez les feuillus, il n’y a généralement pas de torus, donc pas de fermeture possible comme chez les résineux, mais la membrane de la ponctuation a des pores suffisamment petits pour répondre au même dilemme « l’eau oui, l’air non », du moins tant que les conditions restent supportables.
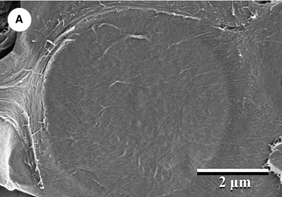
Les ornementations des ponctuations serviraient à réduire le risque d’embolie en renforçant mécaniquement la membrane de la ponctuation pour limiter sa déformation et l’étirement de ses pores (Fig. 31). Les ponctuations ornées se rencontrent d’ailleurs plus souvent chez les espèces des régions les plus chaudes.
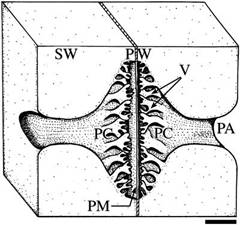
Figure 31. Représentation d’une ponctuation intervasculaire ornée (Flabellaria paniculata). Paroi secondaire ou secondary cell wall (SW) ; ornementations ou vestures (V) ; chambre de la ponctuation ou pit chamber (PC) ; ouverture de la ponctuation ou pit aperture (PA) ; membrane de la ponctuation ou pit membrane (PM) ; paroi primaire + lamelle moyenne ou primary cell wall + middle lamella (PW). (barre = 2 μm)[5]
Les membranes de ponctuation les plus épaisses, avec les pores les plus fins, se trouvent chez les espèces les moins sujettes à la formation de germes d’air par trop forte transpiration. La figure 32 montre les membranes de ponctuations intervasculaires de deux espèces ligneuses, une xérophile (espèce adaptée à la sécheresse), le laurier (Laurus nobilis) et une hydrophile, le saule blanc (Salix alba). Dans le premier cas, la porosité n’est pas visible ; dans le deuxième cas, les pores atteignent un diamètre supérieur à 200 nm et la membrane laisse entrevoir le lumen de la ponctuation dans le vaisseau adjacent.
|
|
|
Figure 32. Membranes de ponctuations intervasculaires du laurier (A, Laurus nobilis) et du saule blanc (B, Salix alba) (la paroi secondaire a été enlevée)[6]
Par ailleurs, les espèces forestières tolérantes à la sécheresse ont un bois dense, avec des parois cellulaires épaisses, qui résistent mécaniquement aux pressions très négatives. Il existe une relation entre la résistance à l’embolie estivale et le rapport (t/b)2 d’une part (Cf. légende de la Fig. 33) et avec la densité du bois d’autre part, aussi bien chez les feuillus que chez les résineux.
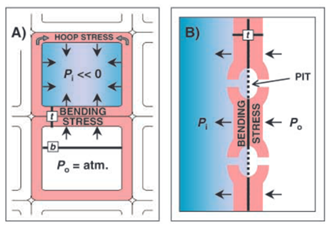
Figure 33. Le risque d’implosion et de propagation de l’embolie en cas de sécheresse. A) Les contraintes de flexion (bending stress) exercées sur la paroi cellulaire d’un vaisseau fonctionnel sont plus importantes au niveau de la paroi commune avec un vaisseau embolisé ; elles dépendent de l’épaisseur de la double paroi (t), de la largeur de la paroi commune (b) et de la différence de pression entre les deux cellules (Pi-Po) ; B) Ces contraintes de flexion s’exercent au niveau des zones entre ponctuations. Au niveau des ponctuations, il y a un risque d’entrée d’air par la membrane et de propagation de l’embolie[7].
3.5.7. Embolie hivernale
Charrier et al. (2014) [8] proposent un mécanisme pour expliquer l’embolie due au cycle gel/dégel (Fig. 34). Dans des échantillons modérément déshydratés, certains vaisseaux sont remplis d’air avant le gel (A). Lors du gel, la glace se propage à travers les vaisseaux avec formation de bulles d’air à l’interface (l’air étant soluble dans l’eau liquide mais pas dans la glace) et une diminution locale du potentiel hydrique entraîne la formation de germes d’air depuis le vaisseau embolisé voisin (B). Ces germes d’air donnent des bulles de différentes tailles piégées dans la glace qui progresse (C). Les bulles de gaz peuvent coalescer et se dilater pendant le dégel (D) et conduire à l’embolie (E).

Figure 34. Mécanisme de l’embolie hivernale
Le risque d’embolie hivernale augmente avec le diamètre des vaisseaux car le nombre de bulles d’air susceptibles de coalescer est plus important et les grosses bulles d’air sont plus difficiles à résorber que les petites. L’influence du diamètre s’explique également par la vitesse de gel et de dégel, une vitesse lente dans de gros vaisseaux favorisant l’apparition de grosses bulles[9].
Les perforations scalariformes (en forme d’escalier) pourraient présenter un avantage pour résister à l’embolie hivernale en bloquant les bulles d’air à l’intérieur de chaque élément de vaisseau. La formation de grosses bulles d’air par coalescence d’un grand nombre de petites serait ainsi limitée.
[1] Zimmermann MH et Brown CL (1971) “Trees. Structure and function”. Springer.
[2] Morris H, Plavcová L, Gorai M, Klepsch M, Kotowska M, Schenk HJ, Jansen S (2018), Vessel-associated cells in angiosperm xylem: Highly specialized living cells at the symplast–apoplast boundary, Am. J. Bot.,105(2): 151–160.
[3] Robert D. et Catesson A.-M. (1990), Biologie végétale, tome 2 : organisation végétative, Doin
[4] Jacobsen AL, Ewers FW, Pratt RB, Paddock IWA, Davis SD (2005) Do xylem fibers affect vessel cavitation resistance? Plant Physiol., Vol. 139, 546–555
[5] Jansen S, Baas P, Gasson P, Lens F, Smets E (2004). Variation in xylem structure from tropics to tundra: evidence from vestured pits. Proceedings of the National Academy of Sciences of the United States of America, 101(23), 8833–8837
[6] Jansen S, Choat B, Pletsers A (2009) Morphological variation of intervessel pit membranes and implications to xylem function in angiosperms, Am. J. Bot. 96(2): 409-419.
[7] Hacke UG, Sperry JS, Pockman WT, Davis SD, McCulloh KA (2001) Trends in wood density and structure are linked to prevention of xylem implosion by negative pressure, Oecologia, 126(4), 457–461
[8] Charrier G, Charra-Vaskou K, Kasuga J, Cochard H, Mayr S, Améglio T (2014). Freeze-thaw stress: effects of temperature on hydraulic conductivity and ultrasonic activity in ten woody angiosperms. Plant Physiology, 164(2), 992-998.
[9] Sevanto S, Holbrook NM, Ball MC (2012) Freeze/thaw-induced embolism: probability of critical bubble formation depends on speed of ice formation, Frontiers in Plant Science, volume 3, article 107
3.6. L’évolution du système vasculaire
3.6.1. L’évolution du système vasculaire selon Bailey
La figure 35 est issue de la publication fondatrice de Bailey et Tupper "Size variation in tracheary cells: I. A comparison between the secondary xylems of vascular cryptogams, gymnosperms and angiosperms" (en français :« Variations de la dimension des cellules trachéaires : I. Comparaison du xylème secondaire des cryptogames vasculaires, gymnospermes et angiospermes »). Elle illustre les tendances évolutives des trachéides vers les fibres à gauche et des trachéides vers les vaisseaux à droite. Elle demeure l’une des images les plus utilisées en botanique. Les observations de Bailey sur l’évolution du xylème proviennent principalement d’études comparatives de longueurs d’éléments trachéaux sur une vaste gamme de plantes vasculaires.
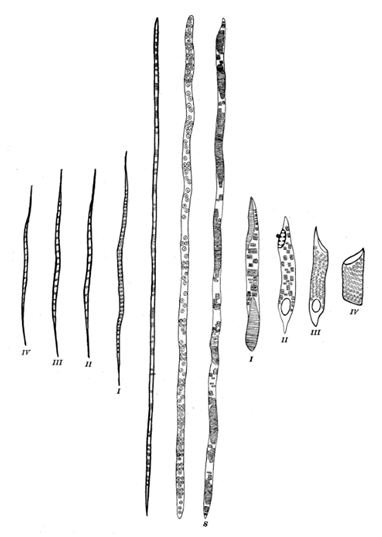
Figure 35. Illustration schématique de la taille moyenne et de la structure des éléments du bois mature de conifères et de différents groupes de dicotylédones. S : trachéide scalariforme de trochodendron (dicotylédone sans vaisseaux) ou dioon (cycaphyte)[1]
Les évolutions proposées par Bailey ont été en partie confirmées par la comparaison de bois fossiles du crétacé et du tertiaire[2]. Les caractères ancestraux (perforations scalariformes, ponctuations intervasculaires opposées/scalariformes, parenchyme diffus) sont plus fréquents au crétacé qu’au tertiaire alors que les caractères dérivés (perforations simples, ponctuations intervasculaires alternées, parenchyme longitudinal aliforme confluent) sont plus fréquents au tertiaire qu’au crétacé.
3.6.2. L’adaptation au milieu
L’avantage adaptatif de certains caractères peut être mis en évidence grâce à leur fréquence dans différents environnements. Ainsi les ponctuations ornées (vestured pits) qui limitent la formation des germes d’air et l’embolie estivale sont plus présentes chez les espèces désertiques que chez les espèces boréales (Fig. 36)[3]. En revanche, les perforations scalariformes qui bloquent les bulles d’air et restreignent le risque d’embolie hivernale se trouvent davantage en région boréale qu’en région désertique.
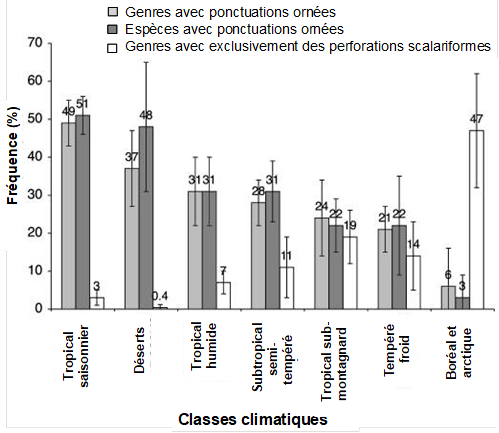
Figure 36. Fréquence des ponctuations ornées et des perforations exclusivement scalariformes dans les angiospermes ligneuses extrapolée à partir des études bibliographiques. Les barres représentent les pourcentages moyens de genres et d’espèces selon différentes catégories macroclimatiques.
3.6.3. Le cas des bois feuillus sans vaisseaux
Parmi les espèces actuelles, on connaît deux clades (ou groupes) d’angiospermes dicotylédones pérennes produisant du bois sans vaisseaux, avec un système conducteur entièrement composé de trachéides :
- Les Trochodendrales avec une seule famille, les Trochodendraceae avec une ou deux espèces asiatiques selon la classification (Trochodendron aralioides et éventuellement Tetracentron sinense)
- La famille des Winteraceae, avec 4 à 9 genres selon la classification, présents en Asie, Océanie, Amérique du Sud et Amérique centrale.
La représentation de Bailey (Fig. 35) montre une trachéide aux ponctuations scalariformes comme celles qui sont présentes dans le bois de Trochodendron.
Ces feuillus produisant un bois sans vaisseaux ont été longtemps considérés comme des feuillus primitifs, proches de leur ancêtre sans vaisseaux. En réalité, ils ont perdu leurs vaisseaux au cours de l’évolution, car toutes les espèces continuent d’évoluer, même celles qui ont conservé beaucoup de caractères ancestraux. Dans le cas des Winteraceae, cette perte des vaisseaux, éléments conducteurs plus sensibles à l’embolie hivernale que les trachéides, serait une adaptation au milieu suite au déplacement de cette famille vers des régions plus exposées au gel.[4]
La figure 37 illustre deux hypothèses : celle d’une apparition unique des vaisseaux au cours de l’évolution, puis de leur disparition dans les deux clades (A) et celle de neuf apparitions et d’aucune disparition (B). Selon le principe de parcimonie, l’hypothèse A est la plus plausible. Elle vient confirmer les données paléogéographiques.
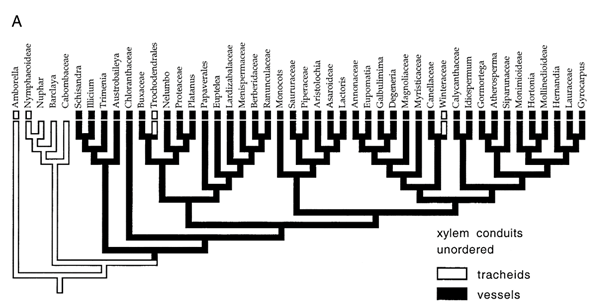
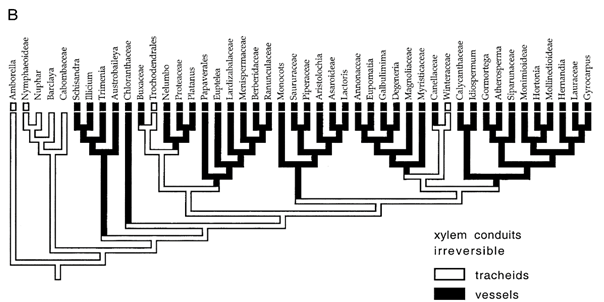
Figure 37. Arbre phylogénique des angiospermes montrant l’apparition des vaisseaux du xylème, selon deux hypothèses, celle d’une apparition réversible (A) et celle d’une apparition irréversible (B)
3.7. L’anatomie systématique comme outil d’identification des espèces ligneuses
Le xylème secondaire a été l’objet au cours de l’évolution de nombreuses innovations adaptatives qui ont induit de multiples variations. L’anatomie du bois est un outil performant d’identification des bois pour laquelle l’expertise humaine reste à ce jour le point de départ essentiel car seul le cerveau humain est capable d’identifier les caractéristiques anatomiques ayant une valeur diagnostique. Au-delà des intérêts de la discipline en biologie, l’identification des bois peut être nécessaire dans le cadre d’expertises judiciaires, de litiges commerciaux, d’enquêtes policières, de problématiques industrielles, d’études historiques ou archéologiques.
L’identification d’un bois feuillu impose souvent d’interroger une base de données. La base de données INSIDEWOOD[5], élaborée par l’IAWA (International Association of Wood Anatomists) est une ressource précieuse, directement accessible sur internet, comptant environ 6000 descriptions. L’anatomie d’un bois est décrite sous forme d’une liste de critères définis précisément par l’IAWA, et numérotés.
3.8. L’anatomie particulière d’Acer saccharum et le sirop d’érable
Certaines espèces du genre Acer (érables) sont connues pour leur capacité à réparer les embolies au printemps grâce à des pressions de sève positives[6].
Chez l’érable à sucre (Acer saccharum), pendant la période de l’année où la sève gèle la nuit et dégèle le jour, la sève brute, sucrée, s’écoule des arbres par les trous percés par les acériculteurs canadiens, à un débit trop élevé pour pouvoir être imputé à la seule poussée racinaire.
La figure 38 montre une spécificité du bois d’érable : les vaisseaux sont au contact direct de nombreuses fibres et leurs parois communes ne portent que des ponctuations simples aveugles, n’existant que du côté fibre. D’autre part, les fibres sont remplies de gaz, ce qui n’est pas le cas de tous les bois.
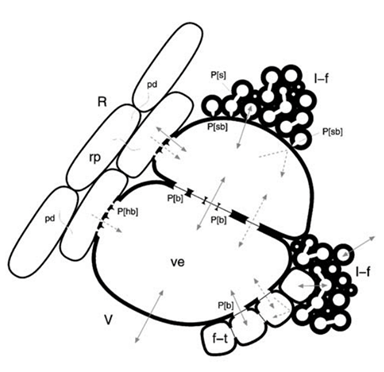
Figure 38. Représentation schématique des différents types de cellules présents dans le xylème de l’érable à sucre, et leur disposition spatiale. Abréviations : V, vaisseau ; ve, élément vaisseau ; R, rayon; rp, ray parenchyma (cellules vivantes) ; l-f, fibres libriformes ; f-t, fibres-trachéides. Coupe transversale montrant les ponctuations (P[type]) (où [hb] = semi-aréolée ; [b] = aréolée ; [s] = simple ; et [sb] = simple aveugle) ; plasmodesmes (pd) entre cellules vivantes de parenchyme radial ; et les passages potentiels de l’eau (flèches pleines) et saccharose (flèches pointillées)[7]
Le mécanisme générant la pression positive serait le suivant :
- La nuit, lorsque la température baisse, le gaz dans les fibres se contracte entrainant une aspiration d’eau depuis les vaisseaux vers les fibres.
- La paroi épaisse entre vaisseaux et fibres, en l’absence de ponctuation, retient le sucre contenu dans les vaisseaux (libéré par ailleurs par les cellules de parenchyme associées aux vaisseaux).
- L’eau aspirée par les fibres gèle et se dépose sous forme de glace sur les parois.
- La glace occupant un plus grand volume que l’eau liquide, l’air à l’intérieur des fibres est comprimé.
Deux phénomènes vont alors concourir à la création d’une pression positive en journée, suite à l’augmentation de la température :
- Lorsque la glace dans les fibres fond, l’eau est poussée dans les vaisseaux par la décompression et la dilatation thermique de l’air
- Le déplacement de l’eau des fibres vers les vaisseaux est mû par une autre force, la pression osmotique créée par la présence de sucre dans l’eau contenue dans les vaisseaux et son absence dans celle contenue par les fibres.
[1] Bailey IW, Tupper WW (1918) Size variation in tracheary cells: I. A comparison between the secondary xylems of vascular cryptogams, gymnosperms and angiosperms. Proceedings of the American Academy of Arts and Sciences USA 54: 147–204
[2] Wheeler EA, Baas P (1991) A survey of the fossil record for Dicotiledonous wood and its significance for evolutionary and ecological wood anatomy, IAWA Bulletin, Vol. 12 (3)
[3] Jansen S, Baas P, Gasson P, Lens F, Smets E (2004). Variation in xylem structure from tropics to tundra: evidence from vestured pits. Proceedings of the National Academy of Sciences of the United States of America, 101(23), 8833–8837
[4] Feild TS, Brodribb T, Holbrook NM (2002) Hardly a relict: freezing and the evolution of vesselless wood in Winteraceae - Evolution, 56(3), 464–478
[6] Sperry JS, Donnelly JR, Tyree MT (1988). Seasonal occurrence of xylem embolism in sugar maple (Acer saccharum). Am. J. Bot. 75, 1212–1218.
[7] Cirelli D, Jagels R, Tyree MT (2008) Toward an improved model of maple sap exudation: the location and role of osmotic barriers in sugar maple, butternut and white birch - Tree physiology, 28:1145–1155, 2008
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU